嗯...今天要來聊一個,怎麼說,有點反直覺的東西。就是抗生素抗藥性。
我們聽到這個詞,第一個反應通常都是...啊,很糟,超級細菌,沒藥醫之類的。這當然沒錯,抗藥性確實是個大麻煩。不過呢,凡事好像都有一體兩面。如果...我是說如果,這個讓細菌活下來的「武器」,我們人類也能拿來用,甚至用在好的地方呢?
聽起來有點怪,對吧。我們先倒帶一下,回到抗生素剛被發現的那個年代。
故事要從盤尼西林說起
大概在二戰期間,有一個叫做安妮・米勒(Anne Miller)的女士,她因為敗血症,就是血液裡都是細菌,基本上快不行了。當時的醫生試了各種方法,輸血、手術...全都沒用。她的病歷上,血液裡的細菌數量,甚至被標上了一個無限大的符號「∞」。
就在最後關頭,醫生給她注射了一種還在實驗階段的新藥,叫做「盤尼西林」,也就是我們說的青黴素。結果...奇蹟發生了。一天之內,她的高燒就退了,人也清醒過來。她成了第一個被盤尼西林救活的人,後來還多活了超過五十年。
這就是抗生素被稱為「奇蹟藥物」的原因。它們真的救了無數人的命,也讓很多以前很危險的手術,像是器官移植,變得可能。但...你知道的,事情總是有「但是」。
抗生素的「無差別攻擊」問題
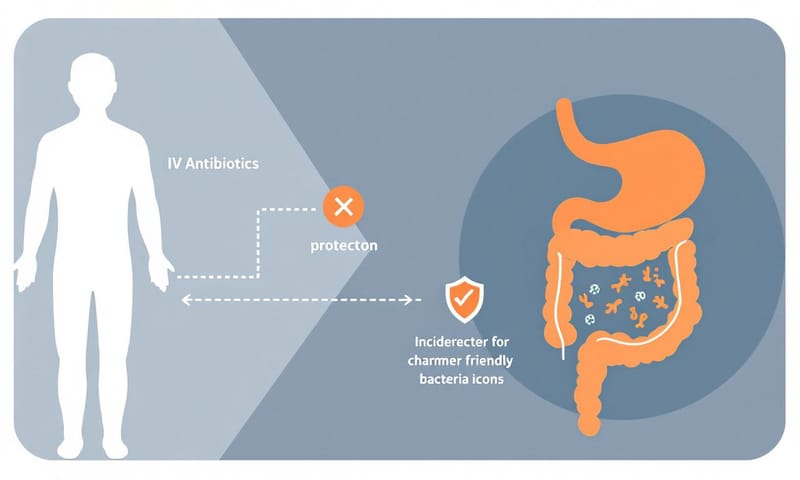
抗生素很強,但它有個問題,就是...有點六親不認。它們的作用原理,通常是針對細菌的一些共通結構,比如細胞壁。所以,在殺死那些讓你生病的壞菌(病原體)時,它也順便把你腸道裡那些跟你和平共存的好菌(共生菌)給一併清除了。
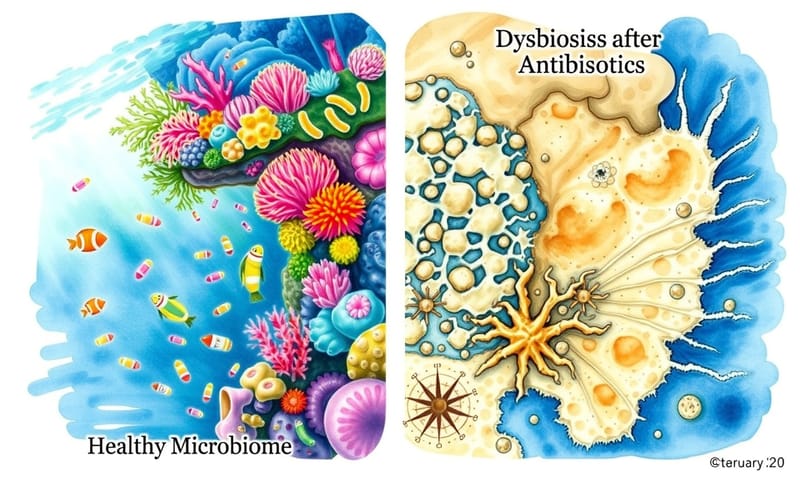
這會造成一個叫「菌叢失衡」(dysbiosis)的狀態。原本腸道裡是個生態很豐富的熱鬧社區,各種菌各司其職。抗生素一來,就像是無差別轟炸,大概三分之一的物種直接消失。這會讓整個環境變得很脆弱。
腸道菌叢被破壞後,可能要花上半年才能慢慢恢復,而且有些好菌可能就再也回不來了。一個健康的腸道菌叢,它的「多樣性」很重要,這就像一個社區裡有警察、有農夫、有工人,大家互相幫忙,也互相制衡。當多樣性降低,就等於社區的防禦力下降了。
這時候,一些平常被壓著打的「機會主義」病菌,就會趁機作亂。其中最麻煩的一個,叫做 Clostridioides difficile,中文是困難梭狀芽孢桿菌,我們簡稱它 `C. diff` 好了。
這傢伙很會抓時機。平常它在腸道裡可能只有一點點,翻不起什麼浪。但你一用抗生素,好菌被清光,地盤空出來了,它就開始瘋狂增長,然後引發嚴重的腹瀉、腸炎,甚至會致命。美國 CDC 把 `C. diff` 造成的感染,列為「緊急」等級的威脅,這已經是最高級別了。諷刺的是,它本身通常不抗藥,但它的崛起,卻是抗生素治療直接造成的後果。這點跟我們在台灣看到的情況蠻像的,疾管署也一直強調,這是在醫院內部需要高度警覺的感染問題,特別是在使用廣效抗生素的病人身上。
用敵人的武器來保護自己?
好了,鋪陳了這麼久,重點來了。
壞菌為了對抗抗生素,演化出了一種很厲害的武器,叫做「β-內醯胺酶」(beta-lactamase)。這是一種酵素,它的專長就是把一類叫做「β-內醯胺類」的抗生素(像是盤尼西林)的化學結構給破壞掉,讓抗生素失效。
然後,就有科學家腦洞大開,想到一個很妙的點子:欸,既然這種酵素是抗生素的剋星,那我們能不能反過來利用它?
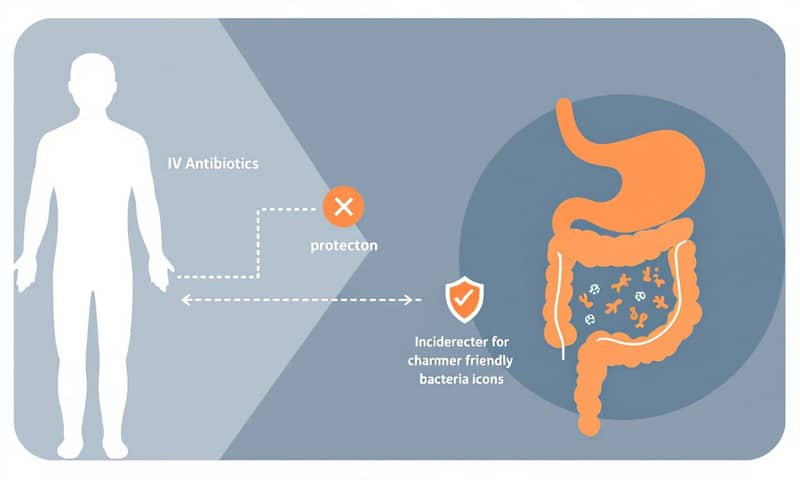
想像一下,當醫生幫你從靜脈注射(IV)抗生素來治療嚴重感染時,藥物會流遍全身,當然也包括一部分會從血液滲漏到你的腸道裡。如果我們能想個辦法,讓這種「β-內醯胺酶」酵素只在腸道裡等著,當抗生素一進來,就立刻把它分解掉。這樣一來,血液裡的抗生素濃度不受影響,可以繼續殺死你身體其他部位的壞菌;而腸道裡的抗生素被清掉了,好菌就能倖免於難。是不是很聰明?
這個想法,就是把「抗藥性」這個壞蛋,變成保護我們腸道健康的保鑣。
兩種有趣的嘗試:做成藥丸 vs. 改造益生菌
目前,有兩家公司正在往這個方向努力,但他們的策略...嗯,有點不太一樣。蠻值得拿來比較一下的。
| 比較項目 | Theriva Biologics (前身是 Synthetic Biologics) | Florey Biosciences |
|---|---|---|
| 他們的方法 | 很直接。把一種叫做 ribaxamase 的 β-內醯胺酶,做成一顆特殊的藥丸。 | 比較繞一點。他們是改造一種益生菌(一種酵母菌),讓這個益生菌在腸道裡幫你製造出這種酵素。 |
| 怎麼運作 | 你吃下這顆藥丸,它的外殼可以抗胃酸,到了小腸才溶解,釋放出酵素。酵素就在那邊等著分解從血液滲進來的抗生素。 | 你吃下的是改造過的益生菌。它會在你的腸道裡「就地生產」分解抗生素的酵素。 |
| 優點 | 成分單純,就是純化的酵素。作用機制很明確,也比較好控制劑量。感覺...嗯,比較像傳統藥物的思路。 | 他們把製造酵素的基因拆成兩半,安全性高。而且因為是活的益生菌,理論上可以持續作用。最關鍵的是,這可能被歸類為「醫療食品」,而不是藥品。 |
| 遇到的問題 | 錢。他們需要做大規模的臨床試驗來證明它能「預防」`C. diff` 感染,這估計要花超過八千萬美金...目前還沒找到願意投資的人。預防疾病,聽起來總比治療疾病難賣錢。 | 技術上比較複雜,要把基因拆開還要能體外重組...聽起來就很科幻。而且雖然不用像藥品那樣燒錢做試驗,但還是要說服醫生和市場接受這種新概念。 |
| 目前的進度 | 有點卡關。雖然早期試驗效果不錯,但就是因為資金問題,大規模的 Phase 3 試驗一直沒辦法啟動。目前只能先轉向一些小範圍的應用,比如用在血癌幹細胞移植的病人身上。 | 他們用了一個很聰明的生物工程技巧來確保安全性,目標是 2027 年左右能推出產品 FLR-101。因為走的是「醫療食品」路線,監管的路徑可能...嗯,會順一點。 |
你看,這兩種方法真的很有意思。一個是直球對決,把解藥做成藥丸,但卡在傳統藥物開發那個超級燒錢的關卡。另一個就想辦法繞路,用更複雜的生物技術,去換取一條...可能比較快,也比較省錢的上市路徑。
所以,「好」或「壞」真的只是角度問題
聊到這裡,我自己是覺得,這整個故事給我們一個很不一樣的視角去看「抗生素抗藥性」。
幾十年來,我們都把抗藥性當成一個敵人,一個要開戰、要消滅的對象。但說真的,從生物學的角度來看,它沒有什麼好壞之分。它就只是一種演化策略,是細菌為了活下去而發展出來的生存之道。因為有用,所以它存在。
是我們人類自己,給它貼上了標籤。β-內醯胺酶,在病菌身上保護病菌,我們就說它是「壞」的;但同樣這個東西,被我們拿來保護腸道好菌,它就變成「好」的了。抗生素也是,在血液裡殺壞菌是「好」的,跑到腸道裡殺好菌就變「壞」的。
這真的...嗯,完全取決於你站在哪個位置,用什麼樣的脈絡去看待它。
當然,我們還是需要新的、更精準的抗生素來對付那些超級細菌。但是,像這種「保護」而非「殺戮」的思路,或許更是一種...怎麼說,更可持續的解法吧。不是想著怎麼把所有看不順眼的微生物都殺光,而是學著怎麼跟這個龐大的微生物世界共存,甚至...利用它們的規則,來為我們服務。
這件事,我覺得比發明一種新的超強抗生素,還要酷得多。
那你怎麼看呢?
對於這兩種保護腸道的方法(直接吃酵素藥丸 vs. 吃改造過的益生菌),你個人覺得哪一種聽起來比較吸引你?或者,你覺得還有什麼潛在的風險沒被提到?在下面留言分享你的想法吧!